Диффузионная ячейка (Вертикальная диффузионная ячейка Франца). Устройство и принцип работы.
Эксплуатационный тест для лекарственных (полутвердых) продуктов— высвобождение лекарственного средства in vitro с использованием вертикальной диффузионной ячейки
Система вертикальной диффузионной ячейки (VDC) является простой, надежной и воспроизводимой для измерения высвобождения различных форм лекарственных средств из полутвердых лекарственных форм (кремы, мази и гели). 200–400 мг крема, мази или геля равномерно распределяют на подходящей синтетической инертной поддерживающей мембране. Мембрану, обращенную стороной с ЛС вверх, помещают в диффузионную ячейку (обычно с отверстием диаметром 15 мм), например, в ячейку Франца. Диффузионная связь между системой доставки и резервуаром осуществляется через инертную высокопроницаемую поддерживающую мембрану. Мембрана отделяет продукт и рецепторную среду. Мембраны выбирают так, чтобы они оказывали наименее возможное диффузионное сопротивление и не влияли на скорость.
Эксперимент со скоростью высвобождения проводят при 32± 1°C, за исключением вагинальных кремов, когда температура должна быть 37 ± 1°C. Отбор проб обычно проводят в течение 4–5 часов, а отобранный объем заменяют свежей рецепторной средой. Для достижения стабильного оттока, рецепторная среда должна обладать высокой способностью растворять или уносить лекарство, и ее концентрация не должна превышать 10% от концентрации эталона в конце теста. Тест проводится с группами из шести ячеек. Результаты по 12 ячейкам — два цикла по 6 ячеек — используются для оценки скорости высвобождения.
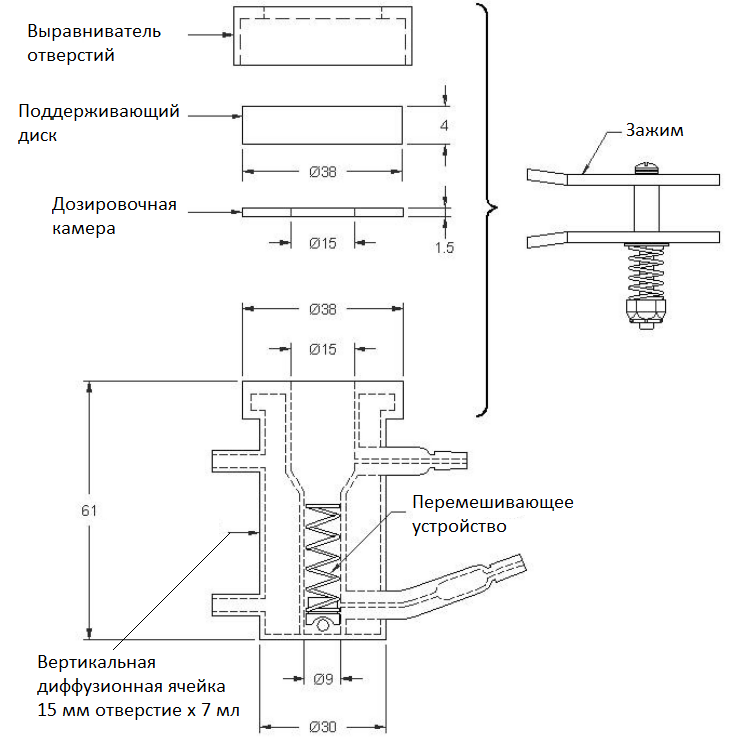
Корпус VDC обычно изготавливается из боросиликатного стекла, но могут быть использованы и другие материалы. Ни один из используемых материалов не должен вступать в реакцию с образцами или поглощать их. В донорском отсеке образец полутвердой лекарственной формы находится на синтетической мембране внутри полости дозировочного отсека, которое закрыто стеклянным диском. Диаметры отверстий донорской камеры и
дозировочного отделения, которое определяет область доставки дозировки для теста, должны иметь размеры в пределах ±5% от указанного диаметра. Отверстие приемной камеры должно быть такого же размера, как отверстие донорской камеры. (Отверстие приемной камеры никогда не должно быть меньше отверстия донорской камеры). Конструкция VDC способствует выравниванию отверстий дозировочного отсека и камеры с рецепторной средой. Толщина дозировочного отделения обычно составляет 1,5 мм. Эта толщина должна быть определена в пределах + 10% от указанной толщины.
Корпус ячейки должен изготавливаться последовательно, с одинаковой высотой и геометрией. Ячейки должны выглядеть одинаково, а объем их внутренних камер должен находиться в пределах ±5% от их указанного объема.
Объем. Перед проведением тестирования определите истинный объем каждой приемной камеры в диффузионной ячейке. При определении объема каждой диффузионной ячейки следует учитывать внутреннее перемешивающее устройство.
Температура. Температура среды приемника во время теста должна оставаться в пределах ±1С от заданной температуры (обычно 32°C).
Скорость. Допустимое отклонение скорости вращения составляет ±10 % от заданной скорости (обычно 600–800 об/мин). Выбранная скорость должна обеспечивать хорошее перемешивание среды приемника во время теста. Время отбора проб. Пробы следует отбирать в указанное время с допустимым отклонением в ±2% или ±2 минуты, в зависимости от того, какая величина больше.
Квалификация. Квалификация аппарата подтверждается проверкой температуры испытания и соблюдением требований к скорости, а также проверочным тестом производительности (PVT). PVT считается пройденным, если два теста шести ячеек соответствуют требованиям FDA с доверительным интервалом 90% (см. Руководство FDA для промышленности: нестерильные полутвердые лекарственные формы; масштабирование и изменения после утверждения: химия, производство и контроль; тестирование выпуска in vitro и документация по биоэквивалентности in vivo, май 1997 г., доступно на сайте www.fda.gov/cder.guidance/1447fnl.pdf). Проверочный тест производительности выполняется одним аналитиком, тестирующим указанный эталонный стандарт в двух экземплярах. Выполняется первый тест с шестью ячейками, который определяется как эталонный. Второй тест из шести ячеек определяется уже как тест. PVT считается пройденным, если второй тест показывает 90%-доверительный интервал по отношению к первому эталонному испытанию.
Процедура. Если иное не указано в отдельной статье, следует дегазировать среду, используя соответствующую технику. Установив перемешивающее устройство, заполните диффузионную ячейку указанной средой и подождите, пока она нагреется до 32°C. При необходимости пропитайте мембрану указанными средами (обычно рецепторными средами) в течение 30 минут. Поместите мембрану в дозировочное отделение и переверните. Нанесите тестируемый материал в полость дозировочного отделения и распределите материал, чтобы заполнить всю полость. Соберите каждый из подготовленных дозировочных отсеков (мембраной вниз и в контакте с рецепторной средой). Важно следить за тем, чтобы при этом под мембраной не было пузырьков. Когда все дозировочные отсеки и остальные компоненты будут установлены, включите перемешивающее устройство с таймером. Следуя указанной методике отбора проб, отберите аликвоту из каждой ячейки для анализа. Убедитесь, что в процессе отбора проб в ячейку не попали пузырьки. Также соблюдайте осторожность при отборе проб и добавлении среды, чтобы не образовались пузырьки. Для некоторых клеток допускается наличие до трех пузырьков под мембраной, если диаметр пузырьков менее 1 мм. С некоторыми ячейками пузырьки могут быть удалены из приемной камеры во время теста путем наклона ячейки (только один раз).