Блог
Операционная система IntegrOS - 21 CFR часть 11 для тестеров растворения и распадаемости Electrolab
Пользователям, особенно в регулируемых отраслях, таких как, в первую очередь, фармацевтическая отрасль, необходимы решения, минимизирующие время, которое тратится персоналом на выполнение нормативных требований, но при условии их гарантированного соблюдения. Компания Electrolab, Индия, производитель фармакопейных тестеров Electrolab, в сотрудничестве с IT-разработчиками представили удобную операционную систему integrOS, обеспечивающую целостность данных Data Integrity, полностью соответствующую 21 CFR часть 11.

Что такое21 CFR часть 11?
- Кодекс федеральных правил (CFR) представляет собой кодификацию общих и постоянных правил и положений, опубликованных в Федеральном реестре.
- Эти правила публикуются Исполнительными департаментами Федерального правительства Соединенных Штатов.
- Часть 11 является частью раздела 21 CFR, который устанавливает правила Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США в отношении электронных записей и электронных подписей (ERES).
- Часть 11 определяет критерии, в соответствии с которыми ERES считаются заслуживающими доверия, надежными и эквивалентными бумажным записям.
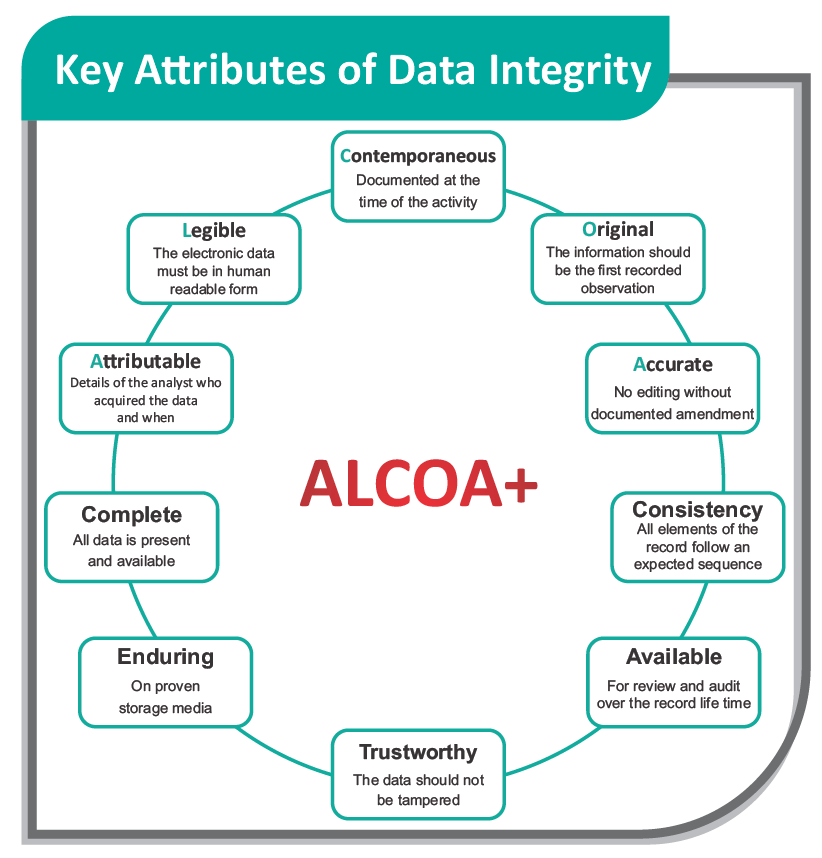
Что такое целостность данных Data Integrity?
- Целостность данных это необходимое условие для регулируемой отрасли здравоохранения, поскольку решения и предположения о качестве продукции и соответствии требованиям GMP основаны на этих данных.
- Целостность данных в среде GMP можно определить как создание, преобразование, поддержание и обеспечение полноты, согласованности и точности данных на протяжении всего жизненного цикла в соответствии с применимыми правилами.
GMP
- Для обеспечения безопасности и эффективности лекарств основные регулирующие органы установили нормативные стандарты, называемые обычно Надлежащей производственной практикой (GMP).
- GMP обеспечивает надлежащее проектирование, мониторинг и контроль производственных процессов и объектов для различных систем.
- Это подтверждается необходимыми данными для отслеживания производственных процессов, которые могут подтвердить что лекарства были изготовлены в соответствии с согласованными регламентами.
Потребители вправе рассчитывать на то, что лекарства, которые они употребляют, безопасны и эффективны. Регулирующие органы, такие как FDA US, UK MHRA и Indian FDA, установили стандарты надлежащей производственной практики (GMP), соблюдение которых гарантирует безопасность и эффективность фармацевтической продукции. GMP – это надлежащее проектирование, мониторинг и контроль производственных процессов и оборудования. Соответствие GMP подтверждается записями данными, которые свидетельствуют об их соответствии утвержденным протоколам.
Целостность данных – это их полнота, согласованность, непротиворечивость, точность, разборчивость, синхронизация, оригинальность (или точная копия). Целостность данных должна обеспечиваться на протяжении всего производственного цикла и в любой системе, используемой для хранения, обработки или извлечения информации. Обеспечение целостности данных – это защита от случайного или преднамеренного изменения, фальсификации, злого умысла (мошенничества) и даже удаления (потери данных). Необработанные данные служат доказательством безопасности и качества лекарств и их производства в соответствии с рекомендациями GMP. Поэтому нарушение целостности данных считается ведущими регулирующими органами (FDA USA, UK MHRA, Health Canada и FDA Индии) серьезным нарушением.
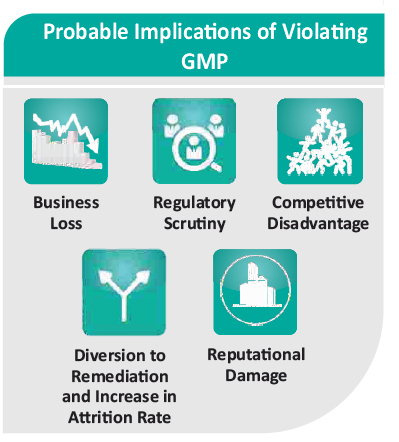
В последние годы FDA все чаще во время проверок выявляет нарушения целостности данных. Указываются серьезные недостатки в том, как сотрудники обрабатывают важные записи и документы, цитируются сообщения о записях, найденных в мусорных баках, несовпадении данных с результатами испытаний, о несанкционированных манипуляциях с необработанными электронными данными, о повторном тестировании образцов для получения желательных результатов и об удалении нежелательных результатов, о практике выполнения пробных инъекций для анализов ВЭЖХ и т.д. и т.п. Основными причинами этих нарушений являются недостаточная осведомленность, нехватка рабочей силы, количественный, а не качественный подход, недостаточное обучение. Нарушения целостности данных вызывают самые разные действия со стороны регулирующих органов – это письма с предупреждениями, отзыв лекарственных средств, уведомления об импорте и о согласии. Эти меры не только сказываются на доходах компании, но также влияют на регистрацию новых лекарственных средств. Кроме того, наносится ущерб репутации и конкурентоспособности компании, а для восстановления этого требуется время, деньги и человеческие ресурсы. Целостность данных имеет решающее значение для соблюдения нормативных требований и, таким образом, является фундаментальной причиной создания Свода федеральных нормативных актов (CFR). В разделе 21 CFR Часть 11 установлены требования к хранению электронных записей, в общей сложности 19, при соблюдении которых они считаются заслуживающим доверия, надежным и эквивалентным бумажным записям.
Из-за недостаточного внимания к этим требованиям или их понимания фармацевтами и даже производителями аппаратуры могут возникать проблемы, которые, если их выявят аудиторы, могут иметь пагубные последствия.
Некоторые из часто наблюдаемых проблем:
Несоблюдение правил администрирования лабораторной системой; совместное использование идентификаторов входа и паролей для лабораторных систем; отсутствие аудита и инспекций для выявления потенциальных пробелов в обеспечении целостности данных; незнание требований 21 CFR Часть 11; отключение контрольных журналов на лабораторном оборудовании и отсутствие четко документированных СОП по резервному копированию и удалению данных. Среди всех вышеперечисленных проблем совместное использование учетных данных (для упрощения входа в лабораторную систему и из соображений экономии) является самой распространенной проблемой, на которую ссылается FDA в своих наблюдениях.
В мире, ориентированном на комфорт, создание удобного доступа сводит к минимуму нарушения правил GMP. Пользователям, особенно в регулируемых отраслях, необходимы решения, минимизирующие время, которое тратится персоналом на выполнение нормативных требований, но при условии их гарантированного соблюдения. Для обеспечения полного соответствия СОП 21 CFR часть 11 и преодоления всех перечисленных выше проблем, а также укрепления безопасности организации, компания Electrolab в сотрудничестве с IT-разработчиками представила удобную операционную систему integrOS, соответствующую 21 CFR часть 11.
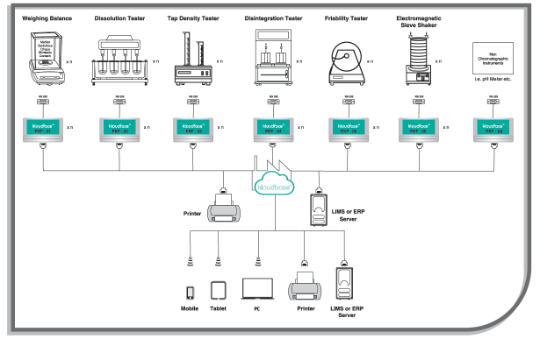

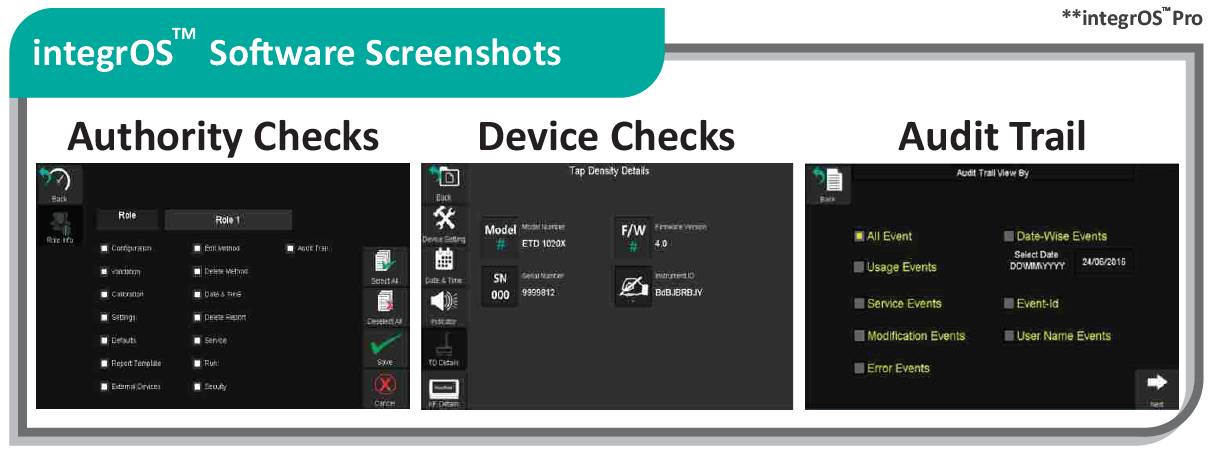
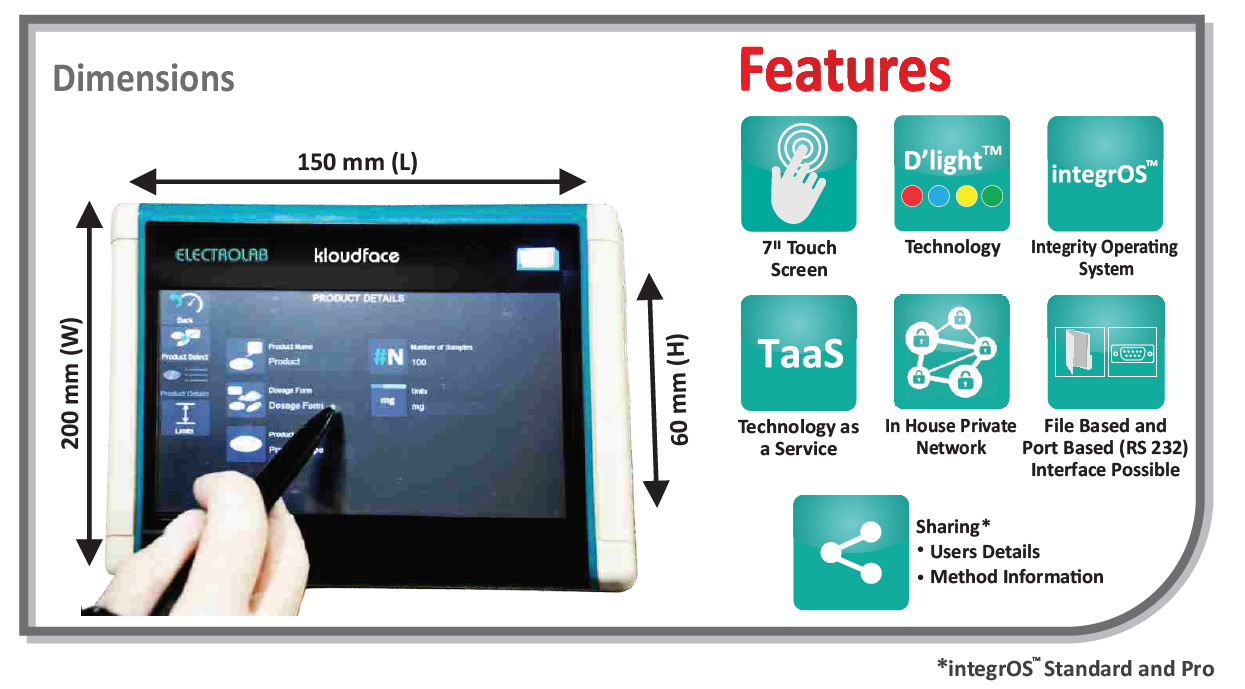

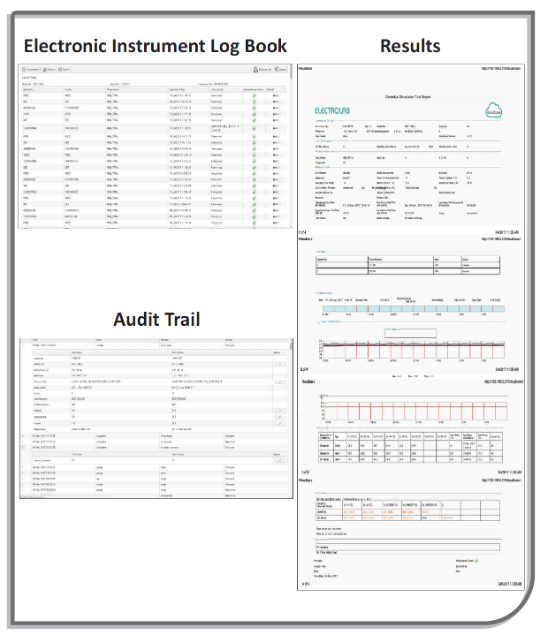
Операционная система integrOS способствует оптимизации и повышению эффективности производственного процесса и работы исследовательской лаборатории и обеспечивает соответствие регуляторным требованиям. Напишите нам, что-бы купить тестер растворения с операционной системой IntegrOS